高中化学原电池电极知识点反应式 原电池是一种将化学能转化为电能的装置,其核心在于通过氧化还原反应产生电流在原电池中,有负极和正极之分,负极是失去电子的极,发生失电子的反应正极是得到电子的极,发生得电子的反应以下是一些常见原电池的反应式1 铝镍电池负极Al,正极Ni,电解液NaCl溶液O。
原子团不要混淆,1价的铵根氢氧根,2价的硫酸根和碳酸根,3价的磷酸根1价的氟氯溴碘氢,以及金属钾钠银,2价的氧钡钙镁锌,铝3价硅4价,都是常见价态高中化学原电池的口诀顺口溜是一般来说,原电池中较活泼的金属作为负极,较不活泼的金属或能导电的非金属作为。
电解质为H2SO4溶液酸性电解质时,负极反应为H2 +2e === 2H+正极反应为O2 + 4H+ + 4e === 2H2O电解质为NaCl溶液中性电解质时,负极反应为H2 +2e === 2H+正极反应为O2 + H2O + 4e === 4OH甲醇燃料电池采用铂作为两极,可使用碱性或酸性电解质当电。
2镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为负极2Al+8OH--2×3e-=2AlO2-+2H2O正极6H2O+6e-=6OH-+3H2 3在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有。
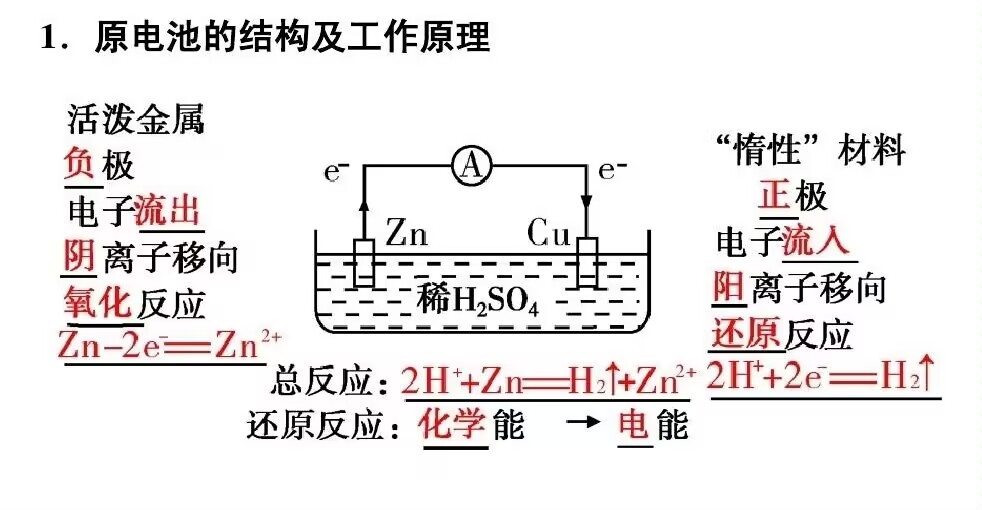
高中化学原电池与电解池知识点 一原电池 1 原电池的定义原电池是将化学能转变为电能的装置2 原电池的工作原理 负极活泼金属失电子,发生氧化反应正极溶液中阳离子得电子,或氧气得电子如燃料电池,发生还原反应电子流向从负极沿导线流向正极,形成电流离子移动阴离子向负极移动。



发表评论